Van spierbiopsie naar beeldbiopsie
Dr. Donnie Cameron onderzoekt de mogelijkheden van MRl bij spierziekten
Na decennia van intensief onderzoek vol hoop, teleurstellingen en nieuwe ontwikkelingen, worden patiënten sinds het begin van de jaren 2000 succesvol behandeld met gentherapie. De eerste successen waren gericht op bloedaandoeningen maar, meer recentelijk, worden ook gentherapieën ontwikkeld voor de behandeling van spierziekten, waaronder Duchenne. Onderzoeker dr. Manuel Gonçalves is optimistisch: hij gelooft dat het mogelijk is om ook voor Duchenne een effectieve en veilige gentherapie te ontwikkelen.
“Met deze nieuwe technologieën kunnen we verschillende gentherapieën voor de ziekte van Duchenne onderzoeken.” – dr. Manuel Gonçalves
DNA is een molecuul dat genetische informatie bevat die elk individu definieert. Het zit in de kern van elke cel en bevat alle instructies (de genetische code) die nodig zijn voor de bouw en het overleven van elke individuele cel in ons lichaam.
Het DNA bestaat uit een reeks van chemische letters die, afhankelijk van de volgorde, verschillende instructies geven. Er zijn ongeveer 23.000 specifieke leesvolgordes van deze letters, ook wel genen genaamd. Net zoals de volgorde van letters woorden vormt, vormt de leesvolgorde in een gen de informatie voor het maken van eiwitten. Deze eiwitten vervullen vervolgens essentiële functies in de cel. Wordt er een ‘letter’ verwijderd, toegevoegd of gewijzigd, dan verliest dat gen zijn betekenis.
Dit soort fouten kunnen ziekten veroorzaken door het ontbreken of verkeerd functioneren van eiwitten. In het geval van Duchenne spierdystrofie treden de fouten op in het gen dat verantwoordelijk is voor de aanmaak van dystrofine, een eiwit dat nodig is om spierweefsels sterk en gezond te houden. Door de fout kan het eiwit niet worden aangemaakt.
Het team van dr. Manuel Gonçalves onderzoekt manieren om het genetische probleem van Duchenne aan te pakken. Manuel: “De enige effectieve manier om een genetische ziekte zoals Duchenne te behandelen, is door een ‘gezonde’ kopie van het aangetaste gen in de cellen van de patiënt te plaatsen (via klassieke gentherapie) of door de fout in het defecte gen te corrigeren (via gen-editing). Beide technieken herstellen de genetische code van het dystrofine-gen in de cellen.”
Klassiek? Corrigeren? Dat heeft wat meer uitleg nodig. Manuel neemt ons mee: “Je kunt een genetische ziekte zien als een auto (de cel) met een kapotte lamp (het gen met de ziekte veroorzakende fout). Bij klassieke gentherapie wordt er een nieuwe lamp toegevoegd boven op het dak van de auto in plaats van de lamp te repareren. Met gen-editing technologieën om het gen te corrigeren kunnen de onderzoekers de kapotte lamp direct op zijn normale plaats repareren.
Het herstellen van de genetische code is permanent, vertelt Manuel. “Een nadeel van gen-editing technieken, zoals CRISPR/Cas9 (de ‘moleculaire schaar’ waar je misschien al eens van hebt gehoord), is dat het knippen in het DNA ook ongewenste veranderingen kan veroorzaken – oftewel nieuwe fouten.”
“Een nieuwere gen-editing techniek, prime-editing genaamd, is nauwkeuriger dan CRISPR/Cas9 en maakt geen breuken in het DNA. Je kunt prime-editors zien als een soort zoek-en-vervang systeem: eerst wordt de fout in het DNA gezocht en daarna wordt deze fout herschreven naar de juiste, gecorrigeerde versie – net zoals een slimme teksteditor dat zou doen.”
“Prime-editors zijn opgebouwd uit meerdere en grote onderdelen, wat het lastig maakt om ze met de gebruikelijke aanleveringssystemen in spiercellen te krijgen, omdat deze te weinig plaats hebben. Ons werk onderscheidt zich ten opzichte van andere, omdat wij een nieuw aanleveringssysteem onderzoeken dat alle onderdelen van de prime-editor in één keer kan leveren. Met deze nieuwe technologieën kunnen we verschillende gentherapieën voor Duchenne onderzoeken.”
Het is de onderzoekers gelukt om met het nieuwe aanleveringssysteem de prime-editors effectief in cellen af te leveren. “Ons systeem is speciaal ontworpen om fouten in het dystrofine-gen te corrigeren in menselijke spier- en hartcellen”, aldus Manuel.
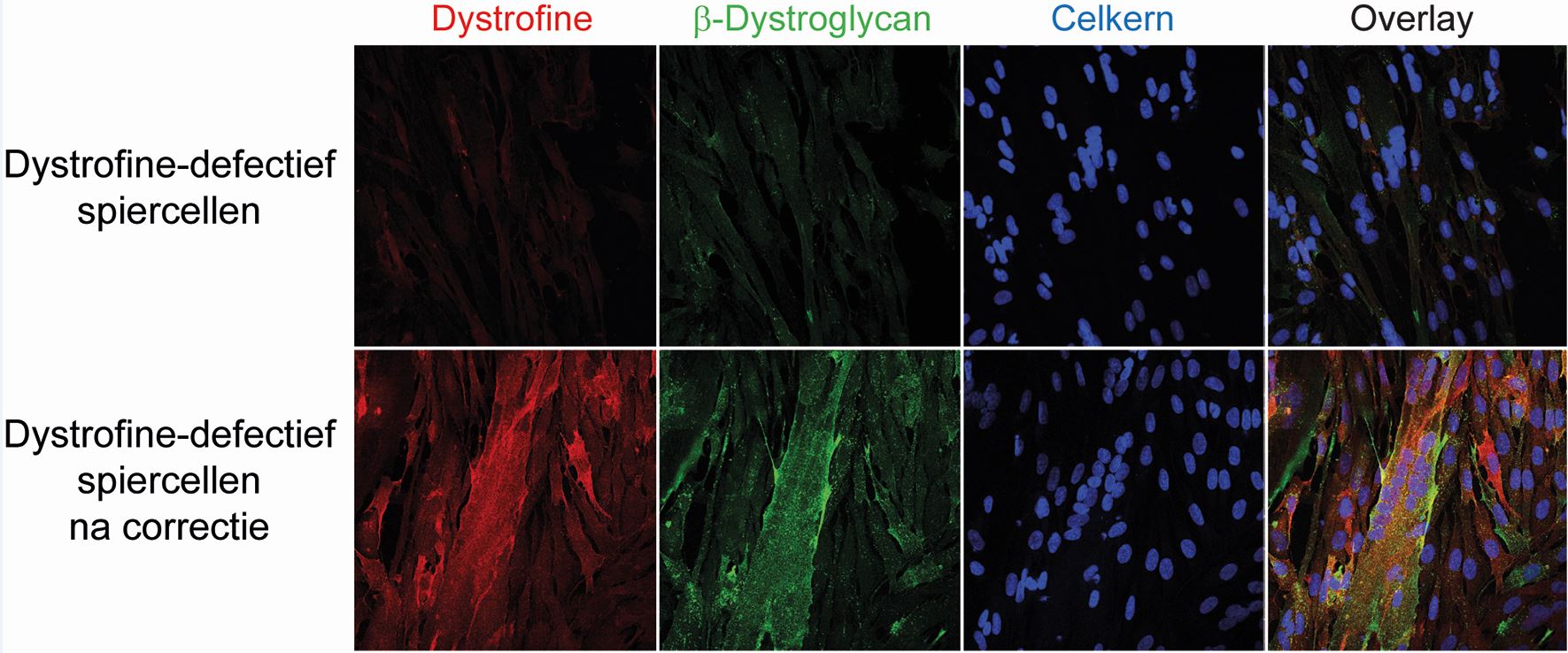
“Hier hebben we in gekweekte menselijke spiercellen laten zien dat we, na het corrigeren, herstel van dystrofine-eiwitproductie (in rood) kunnen bereiken. We zien ook stabilisatie van eiwitten die samenwerken met dystrofine (in groen). In blauw zie je de celkernen. Als je de beelden samensmelt, zie je dat ze overlappen. Dat betekent dat de dystrofine ook echt terug te vinden is in de spiercellen.”
De technologieën ontwikkelen zich razendsnel, maar technieken zoals prime-editors zijn nog relatief nieuw. Manuel benadrukt daarom dat de onderzoekers meer tijd en middelen nodig hebben om ervoor te zorgen dat klinische testen op een veilige manier kunnen worden uitgevoerd.
De opgedane kennis en de ontwikkelde technieken die dit onderzoek opleveren kunnen in de toekomst worden aangepast voor andere spierziekten.