Van spierbiopsie naar beeldbiopsie
Dr. Donnie Cameron onderzoekt de mogelijkheden van MRl bij spierziekten
Wat als een fout in je DNA kan leiden tot ernstige spierziekten? Bij patiënten met de ziekte van Duchenne zit de genetische fout in het dystrofine-gen. Door die fout wordt het dystrofine-gen onleesbaar voor de eiwitvertaalmachine, waardoor het lichaam het dystrofine-eiwit niet of verkeerd aanmaakt. Dit eiwit is nodig voor de stevigheid van de spieren. Als dystrofine ontbreekt, beschadigen de spiercellen en sterven ze op den duur af.
Onder leiding van prof. dr. Niels Geijsen willen de onderzoekers in het Leids Universitair Medisch Centrum methodes ontwikkelen om de fout in het DNA te herstellen en daarmee de functionaliteit van het dystrofine-eiwit.
Prof. dr. Niels Geijsen legt het als volgt uit: “Om de fout te herstellen gebruiken we in ons onderzoek een soort moleculaire schaar, ook wel CRISPR/Cas genoemd. We hebben in het lab de toediening van CRISPR/Cas in cellen goed onder de knie gekregen, waardoor we nu heel precies genen kunnen corrigeren. De moleculaire schaar knipt gericht in de cel rond de fout in het gen, waarna de cel zelf de overgebleven stukken DNA weer aan elkaar plakt. Wat overblijft? Een dystrofine-gen dat weer leesbaar is voor de eiwitvertaalmachine. Het maakt dan een eiwit dat kleiner is, maar wel werkt.”
Omdat er een eiwit wordt aangemaakt dat kleiner is dan normaal en ook minder goed werkt dan normale dystrofine, kun je niet spreken van genezing. Maar omdat je lichaam zo een gedeeltelijk functioneel eiwit aan kan maken, hopen de onderzoekers de verdere achteruitgang te vertragen.
Wereldwijd zijn onderzoeker bezig met het begrijpen van de ziekte en het zoeken naar een oplossing. Niels: “Dit heeft ons onderzoek heel erg geholpen, immers is ons onderzoek gebaseerd op het werk van velen anderen voor ons. Zo hebben we bijvoorbeeld de locatie op het DNA en de beoogde ‘reparatie’ van het gen gebaseerd op beschikbare kennis in het wetenschappelijke veld. Met deze basis kunnen we de technologieën die wij in ons lab hebben ontwikkeld optimaal inzetten voor Duchenne.”
De aanpak is op een aantal vlakken wat anders dan dat van andere gentherapie onderzoekers, geeft Niels aan. “Wij zijn namelijk bezig met een lokale aanpak – gericht op de armfunctie, omdat een lichaamsbrede aanpak wellicht meer bijwerkingen met zich meebrengt. Daarnaast hebben via patiënten en naasten gehoord dat de armfunctie belangrijk is voor de kwaliteit van leven.”
De technologie die centraal staat in dit onderzoek is iTOP. Dat is de truc waarmee het onderzoeksteam CRISPR/Cas de cel in krijgt. Maar hoe werkt dat eigenlijk?
“Laat ik bij het begin beginnen: om elke cel zit een celmembraan”, legt Niels uit. “Dat is een soort huid die als doel heeft om alles wat buiten de cel zit, buiten te houden en wat binnen zit, binnen te houden. Eiwitten kunnen daar niet doorheen, die zijn te groot. Nou hebben we een paar jaar geleden een trucje bedacht waardoor cellen eigenlijk gedwongen worden om toch dingen van buiten op te nemen en dan binnen in de cel weer los te laten. Dingen zoals CRISPR/Cas bijvoorbeeld.”
De onderzoekers willen niet alleen onderzoeken hoe je het DNA aan kan passen, maar vooral ook hoe dit op een veilige manier kan. Ze moeten zeker weten dat de knipplekken alleen gericht zijn op het dystrofine-gen en niet per ongeluk ook ergens anders in het DNA knippen. Door de kniplocatie zorgvuldig te kiezen, kunnen ze CRISPR/Cas-schaar precies afstemmen op het doel. Dat doel is dus ook nog een ding waarnaar ze kijken: blijft het alleen in de spier die ze behandelen, of kan het ook door de rest van het lichaam gaan zwerven?
En als ze dat dystrofine-gen dan aan de praat krijgen, hoeveel dystrofine is er dan terug te vinden in de spier? En hoe verdeeld het zich in de spier?
“Zoals bij elke ziekte waarvoor gentherapie wordt ontwikkeld is het een uitdaging om een defect in DNA in voldoende cellen te herstellen, zodat functie zodanig wordt hersteld dat er sprake is van een ‘therapeutisch effect’”, aldus Niels. In het lab hebben de onderzoekers laten zien dat het dystrofine-eiwit weer in de spieren aanwezig is waar het hoort te zijn. Ook hebben ze gezien dat de methode geen ernstige weefselschade of globale bijwerkingen veroorzaakt en vooralsnog lijkt het dat het immuunsysteem de werking niet negatief beïnvloedt.
Hoe komt de therapie de cel binnen? Hoe vind je het juiste DNA? Hoe en waar knipt de moleculaire schaar? Deze technische en voorbereidende stappen in het laboratorium zijn de onderzoekers continu aan het verbeteren om de therapie nóg beter te maken. Inmiddels zijn deze stappen afgerond, laat Niels ons weten. Dat betekent dat ze nu verder kunnen met de volgende belangrijke stappen: ervoor zorgen dat de behandeling voldoet aan alle regels en eisen voor productie.
Hiervoor moet worden voldaan aan de hoogste standaarden voor kwaliteit en veiligheid. Alle behaalde laboratoriumresultaten moeten opnieuw en meerdere keren worden getest om te bevestigen dat het uiteindelijke product, dat bedoeld is voor patiënten, ook echt werkt zoals verwacht. De onderzoekers dienen naast veiligheid te kijken naar de manier van toediening, de monitoring, de dosering, de kans op bijwerkingen, de productiemethode en de aansluiting op de Nationale en Europese wet- en regelgeving.
Als dat lukt, kunnen de onderzoekers het product gebruiken voor de laatste proeven die nodig zijn voordat we het in klinische studies kunnen testen.
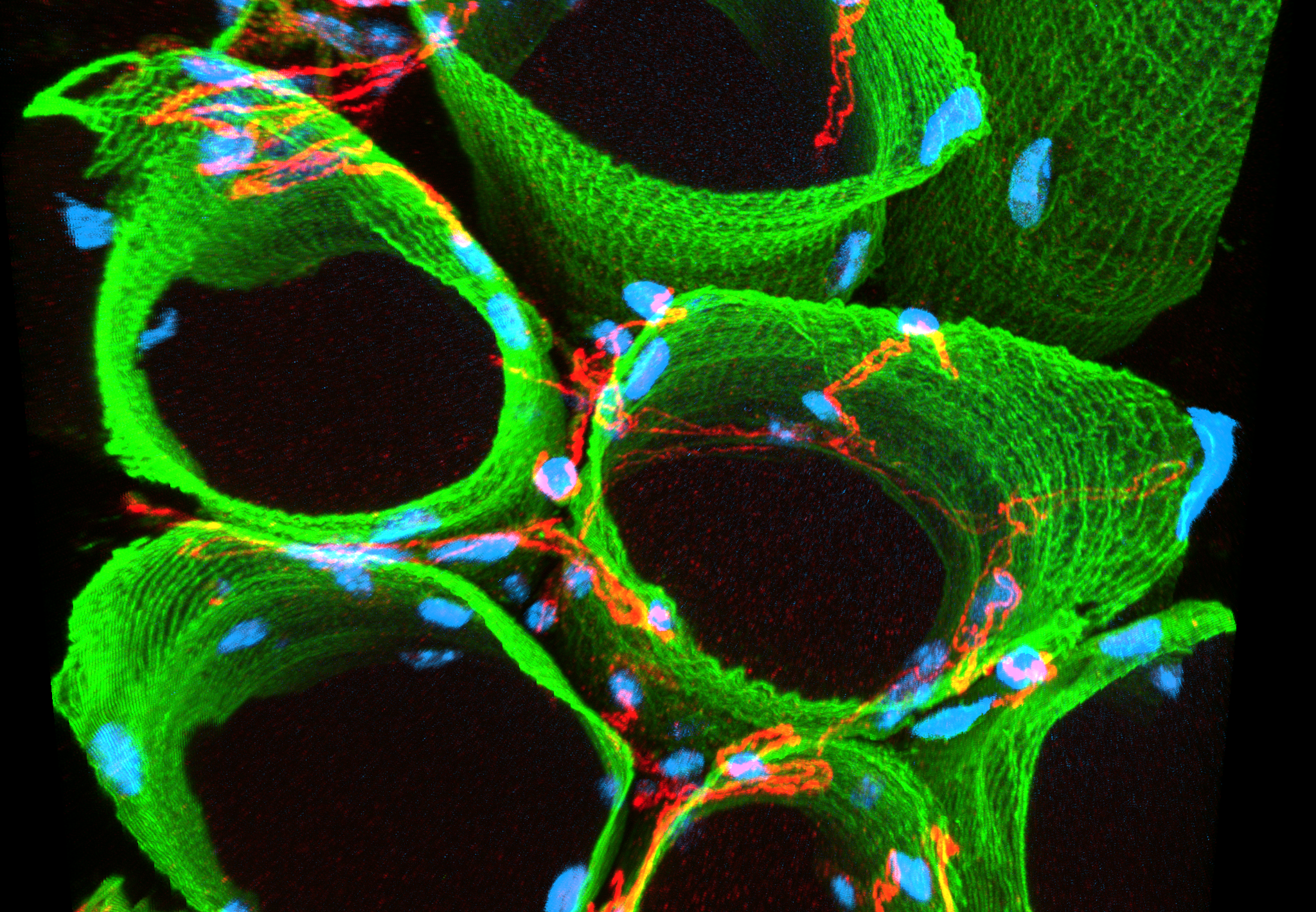
De onderzoeksgroep laat ons beelden zien waarmee ze tijdens de ontwikkeling van de therapie kunnen borgen dat ze de goede kant op gaan. De microscopiebeelden helpen de onderzoekers om te zien of de spiercellen en spierbundels er ‘gezond’ uitzien.
De onderzoeksgroep benadrukt dat het zo mooi is dat ze met een team van meer dan 50 mensen bezig zijn om allerlei aspecten van de beoogde therapie te onderzoeken. De afgelopen jaren hebben ze heel veel gegevens verzameld en geanalyseerd om een beeld te krijgen van het natuurlijk beloop van Duchenne. Niels: “Samen denken we na over welke patiënten in aanmerking komen voor het onderzoek, welke armspier je moet behandelen en hoe je nou meet of de therapie werkt.”
“Met onze methode kan je alleen lokaal behandelen, spier voor spier. We hebben gekozen voor de arm, omdat die voor patiënten heel belangrijk is. Naast het labwerk, gaan we daarom allerlei metingen bij patiënten doen, zoals krachtmetingen en MRI-scans van de spieren. Op basis hiervan hopen we straks de juiste instrumenten te hebben om bij individuele patiënten beter het stadium van de ziekte en het effect van de gentherapie te kunnen bepalen.”
”Dit onderzoek is echt alleen mogelijk door samen te werken om het werk en de perspectieven te bundelen van de verschillende wetenschappers, artsen, farmacologische en regulatoire experts, maar ook de patienten zelf”, aldus de onderzoeksgroep.